污染控制策略(Contamination Control Strategy,CCS)是欧盟GMP无菌附录一(2022年版)的核心概念,其诞生源于对无菌药品质量风险的深化管理需求。早期GMP规范主要依赖终端灭菌和无菌检验作为质量保证手段,但随着监管科学和质量源于设计(QbD)理念的发展,仅靠最终产品检验的局限性逐渐暴露。附录一的修订将CCS提升为强制性要求,强调从源头至终端的系统性控制,要求企业基于科学和风险分析,整合人员、设备、工艺、环境等多维度要素,形成前瞻性、全生命周期的污染防控体系。这一转变,标志着无菌药品监管从“事后检测”迈向“全过程防控”的新阶段。
1.适用范围
CCS的适用范围覆盖所有无菌药品的生产全过程,包括但不限于无菌制剂(如注射剂、眼用制剂)和无菌原料药的生产。其控制范围延伸至相关辅料、内包材、生产工艺(如配制、过滤、灌装)、设备清洁灭菌、环境监控(洁净室级别、微生物与微粒控制)、人员操作规范及更衣流程等。此外,CCS还需兼顾供应链管理(如供应商审计)和厂房设施的设计(如洁净区布局、气流模式),确保从物料入场到产品放行的每一环节均处于受控状态。对于非无菌产品中需控制微生物负荷的工序,CCS的原则也可延伸参考应用。
2.控制目标
CCS的核心目标是通过多层次防控,将微生物、内毒素/热原、微粒等污染风险降至可接受水平。具体包括:
01 杜绝微生物污染
确保无菌产品中无活体微生物存在,需严格管控生物负荷、灭菌工艺有效性及无菌操作条件:如起始物料的生物负荷监控、灭菌工艺的充分开发,充分验证和定期评估、无菌操作的定期优化与评估等。
02 控制微粒污染
避免可见/不可见微粒(如玻璃屑、纤维)对药品安全性的影响;如定期工艺优化、关键设备的周期管理、服装的选择、原辅料包材的质量研究等。
03 预防交叉污染
通过隔离技术、清洁验证等措施防止不同产品或物料间的相互污染;如人物流的单向设计、隔离器的应用等。
04 保障内毒素控制
对水源、物料及设备清洁流程实施严格监控。最终目标是通过系统性防御,确保产品符合“无菌、无热原、无微粒”的质量要求,比如除内毒素工艺的充分研究。
3.开发、编制、评估及动态管理
01 开发编制
CCS的开发需基于科学验证与风险分析,首先识别所有潜在污染源(如人员操作、设备接口、环境暴露),进而通过工艺验证、介质模拟试验、环境监测数据等确立控制措施。例如,针对灌装工序,需结合风速测试、粒子监测、人员资质培训等制定具体规程。
02 评估
评估阶段需定期审核CCS的有效性,通过趋势分析(如微生物监测数据、偏差调查结果)判断控制措施是否充分,并利用工具(如FMEA)优化薄弱环节。
03 动态管理
动态管理要求CCS具备持续改进机制,当发生变更(如工艺调整、设施升级)或出现新的风险时,需重新评估并更新策略,形成“监测-分析-改进-验证”的闭环管理,确保CCS始终与产品和工艺风险相匹配。在充分识别药品生命周期各个环节的风险后,针对每个风险点进行分级管理,依据风险优先级,制定出不同的预防控制措施,然后充分落实在药品生命周期的各个环节。
在实施控制措施的过程中,周期性地评估这些措施的有效性和前瞻性,通过评估和回顾,可能会发现一些潜在的可优化的地方,以促进CCS的持续改进,过程示例可参考下图。
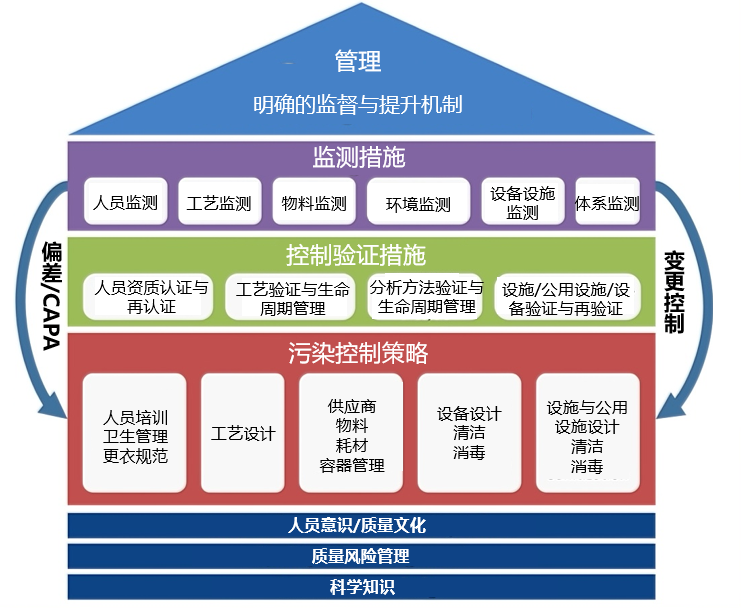
*说明:各个控制要素(红色)是利用基础要素设计的,经过验证以显示它们能合理地达到适当的控制水平(绿色),然后进行监测,以验证它们能达到持续控制(紫色)。红色一行中的单个控制元素并不包括一个详尽的清单。管理(浅蓝色)评估每个CCS 要素的输出(例如,监测数据、验证结果、调査、变更控制),以确保整个CCS保持整体性和有效性。任何一个要素的风险或要素之间的不匹配都会导致CCS的无效性,从而导致污染。
欧盟GMP无菌附录一通过强制实施CCS,推动了无菌药品质量控制体系的革新。企业需以全局视角构建涵盖设计、验证与持续监控的主动防控网络,方能在合规基础上实现产品质量的稳健保障。值得关注的是,国家药品监督管理局药品审评中心(CDE)于2025年3月也更新了GMP的无菌药品附录(征求意见稿),该稿既紧跟国际监管趋势,又充分结合国内产业实际;加之中国在PIC/S方面的申请进展,均表明国内制药行业正在快速融入国际体系。在此背景下,国内制药企业更应化被动为主动,率先布局,积极对接全球制药标准与生态,以推动企业实现更稳健、更可持续的发展。
关于森松生命科技
森松生命科技是森松国际控股有限公司(森松国际,股票代码:2155.HK)的重要业务板块之一,主要由上海森松制药设备工程有限公司、森松(苏州)生命科技有限公司、上海森松生物科技有限公司、上海森众生物技术有限公司、上海森纮科技有限公司、瑞士比欧生物工程公司、瑞典森松法玛度等公司及其附属公司组成。
我们专注于提供制药、生物制药、医美、快速消费品(含化妆品、食品、保健品等)、数据中心等领域的核心设备、工艺系统和数智化整体工厂解决方案及相应服务。 公司拥有一支由工艺研发、工程设计、高端制造、验证咨询、生产执行、数智运维等多领域资深专家的精英团队。团队成员在制药、生物制药、医美、快消、数据中心等行业和领域拥有丰富的经验,熟悉不同产品的特性及工艺流程,能够针对客户的需求,从概念设计阶段起提供定制化的工艺解决方案,满足客户的个性化需求。
森松生命科技已构建起全球战略布局,在全球不同国家和地区建立先进研发、设计中心和制造基地的同时,形成了覆盖欧美、亚太及新兴市场的完善服务网络。公司国际化专业团队已成功为40多个国家和地区提供定制化解决方案,在全球项目执行方面积累了丰富经验。
作为掌握核心工艺技术、模块化建造及数智化工厂技术的跨国企业,森松生命科技致力于满足全球制药、生物制药、医美、快消、数据中心等行业和领域对生产装备的需求。公司通过不断创新和优化,助力国内企业加速实现核心和高端装备的国产替代战略布局,推动行业发展。同时,公司积极拓展海外市场,深化“全球化”业务开拓战略,为全球生命科学及相关行业贡献森松力量。
前瞻性声明
本新闻稿所发布的信息中可能会包含某些前瞻性表述。这些表述本质上具有相当风险和不确定性。在使用“预期”、“相信”、“预测”、“期望”、“打算”及其他类似词语进行表述时,凡与本公司有关的,目的均是要指明其属前瞻性表述。本公司并无义务不断地更新这些预测性陈述。
这些前瞻性表述乃基于本公司管理层在做出表述时对未来事务的现有看法、假设、期望、估计、预测和理解。这些表述并非对未来发展的保证,会受到风险、不确性及其他因素的影响,有些乃超出本公司的控制范围,难以预计。因此,受我们的业务、竞争环境、政治、经济、法律和社会情况的未来变化及发展的影响,实际结果可能会与前瞻性表述所含资料有较大差别。